2024年9月27日,Science在线发表题为 Genetic excision of the regulatory cardiac troponin I extension in high heart rate mammal clades的论文,揭示心脏蛋白的趋同演化以解析小型哺乳动物适应高心率的分子机制研究。我院何锴教授、余文华教授课题组参与该项工作,其中何锴和研究生张梦蝶(硕士研究生)分列第二、第三作者,何锴教授主要负责材料收集、数据分析、课题监督等;研究生张梦蝶和余文华教授参与了组织材料及数据分析等。Maicon Landim-Vieira(佛罗里达大学)和Jose Renato Pinto(佛罗里达大学)教授在同期Science上进行针对性评论,指出从比较基因组学视角可为现代医学与人类健康另辟蹊径。

人类的最大心率可达到200次/每分钟,而小型哺乳动物鼩鼱和鼩鼱的心率能够达到 800 次/每分钟。该研究揭示鼩鼱的祖先在演化过程中从基因组中删除给心脏“踩刹车”的基因位点,让它们心率能维持在较高水平的分子机制。


图1. 大蹄蝠和云南长尾鼩
哺乳动物心肌肌钙蛋白I(cTnI)是由TNNI3基因编码的心脏收缩功能的关键蛋白,具有独特的N端延伸区域和磷酸化位点。当动物受到外界刺激,大脑分泌的肾上腺素会导致cTnI磷酸化,让心脏舒张加快,从而提高全身的供氧能力。而老年人或遗传缺陷人群容易出现因为肾上腺素分泌不足导致的慢性心衰和心肌病。
结合比较基因组、转录组和蛋白组的分析,研究团队证实编码cTnI蛋白N端磷酸化位点的基因外显子在鼩鼱祖先的基因组被删除(假外显子化)。这种遗传变异,反而使鼩鼱的cTnI在缺乏肾上腺素刺激的情况下维持较强的舒张功能。有趣的是,cTnI假外显子化在鼩鼱的近亲鼹类的不同物种中,独立发生五次。 说明在进化选择压力的情况下,不同的哺乳动物会“殊途同归”地选择相同的演化模式。
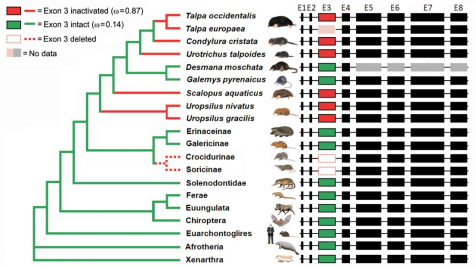
图2. 哺乳动物系统进化树和TNNI3基因外显子3演化示意图。
迄今为止学界普遍认为哺乳动物cTnI 无法发生选择性剪接,而本研究首次证实蝙蝠心脏中同时存在cTnI的两种蛋白形式,即保留磷酸化位点的全长,以及删除磷酸化位点的短链形式。这有可能帮助蝙蝠在飞翔中维持较高的心率(>1000 次/分钟),而在休眠期间维持较低的心率。这一发现改变了学界对cTnI蛋白可变剪切的认知。
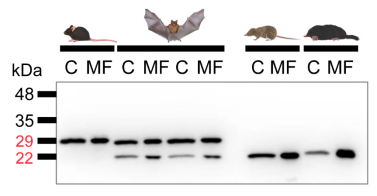
图3. cTnI 在小鼠、鼩鼱和鼹中表达不同的剪切形式,在蝙蝠中同时表达两种可变剪切。
该研究揭示小型哺乳动物心动过速的进化起源和分子基础,从应用生物医学的角度为治疗慢性心衰和心肌病提供潜在的干预和治疗靶点和方案,提示可通过诱导cTnI外显子跳跃的方式改善患者的心脏功能。
奥尔胡斯大学的William Joyce和曼尼托巴大学Kevin L. Campbell分别为论文的第一作者和通讯作者。广州大学何锴教授、余文华课题组参与这项工作,其中何锴和研究生张梦蝶(硕士研究生)分列第二、第三作者。广州大学精准医疗中心的王雄军教授团队为实验提供帮助。该研究得到广东省杰出青年基金(2022B1515020033)、国家自然科学基金(32170452)、广州大学“5+2”平台等资助。
论文链接:https://www.science.org/doi/10.1126/science.adi8146
Science评论:https://www.science.org/doi/10.1126/science.ads2585
