我院神经药理学教授张元伟课题组与美国卫生研究所(NIH) Forrest主任研究员课题组以及奥地利维也纳医科大学Sandtner教授课题组合作,最新研究成果于2024年4月23日在PNAS上发表题为“Identification of the potassium-binding site in serotonin transporter”研究论文。该研究运用生物物理与生物化学以及电生理学的方法,成功确立了 SERT 中 K+离子的结合位点,并揭示了神经递质转运过程中关键分子机制。

神经元信号传导取决于神经递质从突触间隙的有效清除。 为此,5-羟色胺转运体 (SERT) 等膜转运蛋白利用由 Na+/K+-ATP 酶产生的Na+ 和 K+ 离子梯度作为驱动力,从突触间隙再摄取5-羟色胺,以维持5-羟色胺的低水平。 虽然 Na+ 在神经递质跨膜转运的作用已广为人知,但我们对 K+ 在5-羟色胺摄取过程中的作用的理解还很有限。
早期对SERT膜囊泡的研究表明,K+梯度可以驱动SERT的转运过程。这一现象早在30年前就被发现,但具体的反转运机制由于方法的限制一直未能理解。该研究利用分子动力学模拟预测K+的两个可能结合位点Ct1或Ct2 (图1) 以及Asp残基的质子化状态。模拟结果表明SERT中Na+与K+结合之间的复杂相互作用,同时预测Na2位点是K+结合位点。为验证这一假设,通过点突变的手段,突变Na2位点的关键残基,在SERT重组脂质体中观察到突变体对K+不再响应。进一步通过细胞膜片钳的手段,得到了相同的结果。该研究表明K+在SERT由内向构象转变为外向构象这一限速过程中,取代Na2位点的Na+,加速SERT对5-羟色胺的转运。此研究促进了我们对SERT跨膜转运分子机制的认知,对K+离子的神经生理学的理解具有重要意义,
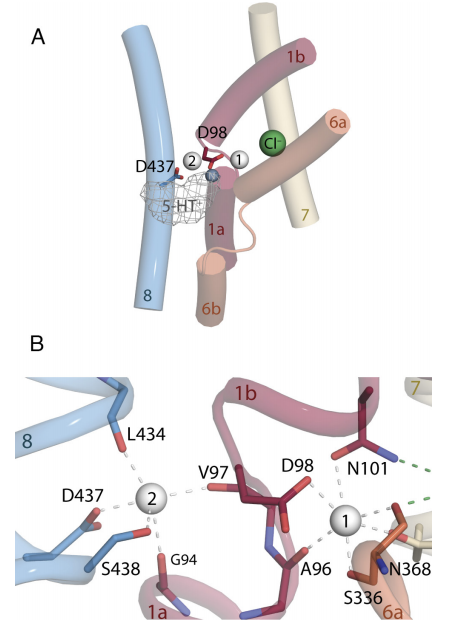
图1. 本研究预测的K+结合位点。K+结合的两个可能的位点Ct1和Ct2位点,每个位点都含有带负电的Asp,分别为Asp98和Asp437。生化以及电生理分析验证K+结合在Ct2。
广州大学张元伟教授、美国卫生研究所Forrest主任研究员和奥地利维也纳医科大学Sandtner教授为本论文的共同通讯作者,广州大学硕士研究生陈清扬、美国卫生研究所博士后Eva Hellsberg博士和奥地利维也纳医科大学博士后Danila Boytsov博士为共同第一作者。本研究得到国家自然科学基金与市校联合基金重点项目资助。
该论文链接为www.pnas.org/doi/10.1073/pnas.2319384121
